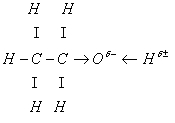Урок по химии Гидроксильные производные углеводородов
(→Цели урока) |
|||
| (не показаны 25 промежуточных версий 1 участника) | |||
| Строка 1: | Строка 1: | ||
| − | + | 10-й класс | |
| − | + | ||
| − | + | ||
| − | |||
| + | Цели урока: | ||
| − | + | Обобщить пройденный материал по теме"Спирты и фенолы", систематизировать изученный материал, устранить пробелы в знаниях. | |
| − | + | ||
| − | + | Закрепить знания учащихся о составе,строении и свойствах предельных(одноатомных и многоатомных)спиртов и фенолов. | |
| + | Расширить понятия о функциональной группе ОН,водородной связи и хим.св-вах орг.соединений данных классов. | ||
| − | + | Совершенствовать умения уч-ся анализировать,сравнивать,устанавливать взаимосвязи между строением и св-вами.О | |
| − | + | братить внимание на многообразие орг.в-в,на постепенное усложнение в-в при переходе от углеводородов к спирту и от углеводорода к фенолу. | |
| + | |||
| + | Уделить внимание проблеме физиологического действия спиртов и вредного воздействия этанола на организм человека.На основе данного материала школьники имеют возможность сделать вывод о взаимосвязи общего и частного,о влиянии количественных изменений на изменения качественные(появление новых свойств). | ||
| + | |||
| + | |||
| + | Проконтролировать качество знаний, умений и навыков. | ||
| + | |||
| + | Ход урока | ||
| + | |||
| + | I. Фронтальный опрос | ||
| + | |||
| + | 1.Какие соединения относятся к гидроксильным производным углеводородов? | ||
| + | |||
| + | 2.Что такое спирты? | ||
| + | |||
| + | 3. Что такое фенолы? | ||
| + | |||
| + | II. Повторение пройденного, обсуждение основных вопросов темы | ||
| + | |||
| + | 1.Каково пространственное и электронное стро¬ение молекул предельного спирта? | ||
| + | |||
| + | ОТВЕТ.В молекулах спиртов предельный углево¬дородный радикал соединен с гидроксильной группой ОН. Атом кислорода в молекуле является самым элект¬роотрицательным, поэтому к нему смещается электрон¬ная плотность от углеводородного радикала и атома во¬дорода и возникает поляризация связи О—Н. | ||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
На доске. | На доске. | ||
| − | + | ||
| − | + | [[Изображение:46847844984.JPG|center|]] | |
| − | + | ||
| − | + | 2.Что вы можете отметить необычного в физи¬ческих свойствах спиртов? | |
| − | + | ||
| − | + | ОТВЕТ. Первые представители гомологического ряда спиртов имеют аномально высокие температуры кипе¬ния и очень хорошо растворяются в воде | |
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | + | ||
| − | атоме кислорода небольшой. Значит, таким же будет и положительный заряд 6+ на атоме водорода. В связи с этим подвижность атома водорода гидроксильной группы небольшая и кислотных свойств этанол (предельный од¬ноатомный спирт) проявлять не будет. | + | 3. За счет чего спирты имеют высокие темпера¬туры кипения? |
| + | |||
| + | ОТВЕТ. За счет образования между молекулами спирта водородных связей. Молекулы спирта представ¬ляют собой комплекс, одну гигантскую молекулу. | ||
| + | |||
| + | 4. Почему спирты, особенно низшие, хорошо растворимы в воде? | ||
| + | |||
| + | ОТВЕТ. За счет образования водородных связей меж¬ду молекулами спирта и воды. | ||
| + | |||
| + | 5. Зависят ли свойства органических веществ от их строения? | ||
| + | |||
| + | ОТВЕТ. Да, свойства вещества зависят от его стро¬ения, и достаточно сильно. Зная свойства вещества, мож¬но предположить его строение. Например, по взаимо¬действию этанола с натрием определили, что один из атомов водорода в молекуле спирта отличается от пяти остальных большей подвижностью и, следовательно, вхо¬дит в состав полярной гидроксильной группы, а не угле¬водородного радикала. Но и по строению можно пред¬положить те или иные свойства вещества. | ||
| + | |||
| + | 6. Как свойства гидроксильных производных зависят от строения их молекул? | ||
| + | |||
| + | ОТВЕТ. Попробуем с помощью цветного мела по¬казать распределение электронной плотности в молеку¬лах: а) этанола, б) глицерина, в) фенола - и предполо¬жить наличие определенных химических свойств. | ||
| + | |||
| + | На доске. | ||
| + | |||
| + | [[Изображение:41611516.JPG|center|]] | ||
| + | |||
| + | Атом кислорода оттягивает на себя элект¬ронную плотность и приобретает избыточный отрицатель¬ный заряд. Но из-за того, что углеводородный радикал отталкивает от себя электронную плотность, заряд 6- на атоме кислорода небольшой. Значит, таким же будет и положительный заряд 6+ на атоме водорода. В связи с этим подвижность атома водорода гидроксильной группы небольшая и кислотных свойств этанол (предельный од¬ноатомный спирт) проявлять не будет. | ||
| + | |||
На доске. | На доске. | ||
| − | + | ||
| − | + | [[Изображение:555555.JPG|center|]] | |
| − | + | ||
| + | В молекуле многоатомного спирта глицери¬на углеводородный радикал распределяет электронную плот¬ность между тремя атомами кислорода. Для того чтобы со¬хранить отрицательный заряд б—, атомам кислорода при¬ходится оттягивать электронную плотность от атомов во¬дорода. Положительный заряд на этих атомах увеличивает¬ся, а значит, увеличивается их подвижность и способность к замещению. Многоатомные спирты в большей степени проявляют кислотные свойства, чем одноатомные. | ||
| + | |||
На доске. | На доске. | ||
| − | + | ||
| − | + | [[Изображение:123456.JPG|center|]] | |
| − | + | ||
| + | Фенол имеет бензольное кольцо, оттягива¬ющее на себя электронную плотность от атома кислоро¬да. Для сохранения отрицательного заряда атому кисло¬рода приходится оттягивать электронную плотность от атома водорода в еще большей степени, чем в предель¬ных многоатомных спиртах. Атом водорода гидроксиль¬ной группы имеет большой заряд 5+ и очень подвижен. Фенол проявляет кислотные свойства, другое его назва¬ние - карболовая кислота. | ||
| + | |||
Учитель подводит итоги этой части урока и сообщает уча¬щимся, что они могут приступить к выполнению письменной работы по индивидуальным карточкам. | Учитель подводит итоги этой части урока и сообщает уча¬щимся, что они могут приступить к выполнению письменной работы по индивидуальным карточкам. | ||
| − | III. Письменная работа по индивидуальным картам | + | |
| − | Карточка 1 | + | III. Письменная работа по индивидуальным картам Учащимся предлагаются карты различного уровня. Если вы справляетесь с заданием, например, уровня В, то при желании можете выполнить задание уровня А пол¬ностью или частично. |
| + | {| border=1 | ||
| + | |Карточка 1 | ||
| + | |||
Уровень А | Уровень А | ||
| + | |||
1. С помощью выданных химических реактивом распо¬знайте, в какой из пробирок содержится глицерин и фе¬нол. Ответ подтвердите уравнениями реакций (по глице¬рину). | 1. С помощью выданных химических реактивом распо¬знайте, в какой из пробирок содержится глицерин и фе¬нол. Ответ подтвердите уравнениями реакций (по глице¬рину). | ||
| + | |||
2. Предложите методику производства 2,4.6- три нитрофе¬нола, ИСПОЛЬЗУЯ в качестве ИСХОДНЫХ веществ метан, аммиак и другие вещества. Объясните, почему замещение атомов во¬дорода в феноле при нитровании происходит в положениях 2, 4, 6. Назовите вещества. | 2. Предложите методику производства 2,4.6- три нитрофе¬нола, ИСПОЛЬЗУЯ в качестве ИСХОДНЫХ веществ метан, аммиак и другие вещества. Объясните, почему замещение атомов во¬дорода в феноле при нитровании происходит в положениях 2, 4, 6. Назовите вещества. | ||
| + | |||
3. Приведите сравнительный анализ строения и свойств фенола и толуола. Выявите общие черты и отличия в их свой¬ствах. Объясните причины сходства и различия в свойствах этих соединений. Напишите уравнения соответствующих уравнений реакций. | 3. Приведите сравнительный анализ строения и свойств фенола и толуола. Выявите общие черты и отличия в их свой¬ствах. Объясните причины сходства и различия в свойствах этих соединений. Напишите уравнения соответствующих уравнений реакций. | ||
| + | |||
4. Напишите уравнения реакций, которые могли бы про¬демонстрировать генетическую связь между углеводородами и фенолами. | 4. Напишите уравнения реакций, которые могли бы про¬демонстрировать генетическую связь между углеводородами и фенолами. | ||
| + | |||
5. Сколько получится метана при сплавлении ацетата на¬трия массой 10 г и натронной извести массой 10 г, массовая доля гидроксида натрия в которой 80%? | 5. Сколько получится метана при сплавлении ацетата на¬трия массой 10 г и натронной извести массой 10 г, массовая доля гидроксида натрия в которой 80%? | ||
| − | Карточка 2 | + | |
| + | |} | ||
| + | |||
| + | {| border=1 | ||
| + | |||
| + | | Карточка 2 | ||
| + | |||
Уровень В | Уровень В | ||
| + | |||
1. С помощью предложенных химических реактивов рас¬познайте, в какой из двух выданных пробирок находятся ра¬створы глицерина и фенола. Ответ подтвердите уравнения¬ми реакций (по глицерину). | 1. С помощью предложенных химических реактивов рас¬познайте, в какой из двух выданных пробирок находятся ра¬створы глицерина и фенола. Ответ подтвердите уравнения¬ми реакций (по глицерину). | ||
| − | + | ||
| − | + | 2. Проведите сравнительный анализ электронного стро¬ения молекул фенола и бензола. Для этою используйте следующий перечень признаков сравнения: распределение электронной плотности п-электронного облака бензольного ядра, распределение электронной плотности связи О-Н в феноле; наличие атомов водорода в молекуле, замещаю¬щихся в реакциях бромирования и нитрования. Объясни¬те причины выявленных различий. | |
| − | 2. Проведите сравнительный анализ электронного стро¬ения молекул фенола и бензола. Для этою используйте следующий перечень | + | |
3. Проведите сравнительный анализ основных химиче¬ских свойств фенола и толуола. Для этого используйте сле¬дующий перечень признаков сравнения: кислотные свой¬ства; отношение к бромной воде, азотной кислоте, натрию и гидроксиду натрия. Объясните причины выявленных раз¬личий. | 3. Проведите сравнительный анализ основных химиче¬ских свойств фенола и толуола. Для этого используйте сле¬дующий перечень признаков сравнения: кислотные свой¬ства; отношение к бромной воде, азотной кислоте, натрию и гидроксиду натрия. Объясните причины выявленных раз¬личий. | ||
| + | |||
4. Напишите уравнения реакций, лежащих в основе по¬лучения фенола. Где, на ваш взгляд, должны располагаться предприятия по его производству? Где фенол и его произ¬водные применяют? Напишите уравнения реакций, с помо¬щью которых можно осуществить превращения: | 4. Напишите уравнения реакций, лежащих в основе по¬лучения фенола. Где, на ваш взгляд, должны располагаться предприятия по его производству? Где фенол и его произ¬водные применяют? Напишите уравнения реакций, с помо¬щью которых можно осуществить превращения: | ||
а) метан -> ацетилен -> бензол -> фенол -» 2,4,6-три- | а) метан -> ацетилен -> бензол -> фенол -» 2,4,6-три- | ||
| Строка 76: | Строка 115: | ||
б) пропан -» гексан -> циклогексан ~> бензол -> фенол -» | б) пропан -» гексан -> циклогексан ~> бензол -> фенол -» | ||
фенолят натрия. | фенолят натрия. | ||
| + | |||
5. Сколько получится метана, если в реакционную каме¬ | 5. Сколько получится метана, если в реакционную каме¬ | ||
ру для прямого синтеза метана направить смесь, состоящую | ру для прямого синтеза метана направить смесь, состоящую | ||
из углерода массой 2,4 г и водорода объемом 11,2 л? | из углерода массой 2,4 г и водорода объемом 11,2 л? | ||
| − | Карточка 3 | + | |
| + | |} | ||
| + | |||
| + | {| border=1 | ||
| + | |||
| + | |Карточка 3 | ||
| + | |||
Уровень С | Уровень С | ||
| + | |||
1. С помощью предложенных химических реактивов рас¬познайте, в какой из выданных пробирок находятся ра¬створы глицерина и фенола. При необходимости исполь¬зуйте таблицу качественных реакций на органические ве¬щества. | 1. С помощью предложенных химических реактивов рас¬познайте, в какой из выданных пробирок находятся ра¬створы глицерина и фенола. При необходимости исполь¬зуйте таблицу качественных реакций на органические ве¬щества. | ||
| + | |||
2. Опишите физические и химические свойства фенола. Обратите внимание на те из них, которые объединяют фе¬нол со слабыми кислотами. Напишите уравнения реакции, при помощи которой можно доказать, что фенол — слабая кислота. | 2. Опишите физические и химические свойства фенола. Обратите внимание на те из них, которые объединяют фе¬нол со слабыми кислотами. Напишите уравнения реакции, при помощи которой можно доказать, что фенол — слабая кислота. | ||
| + | |||
3. Напишите уравнения реакций, при помощи которых | 3. Напишите уравнения реакций, при помощи которых | ||
можно было бы продемонстрировать генетическую связь | можно было бы продемонстрировать генетическую связь | ||
| Строка 91: | Строка 140: | ||
б) гексан -> циклогексан -> бензол -> фенол —> фенолят | б) гексан -> циклогексан -> бензол -> фенол —> фенолят | ||
натрия. | натрия. | ||
| + | |||
4. Сколько получится фенола, если в реакционную каме¬ | 4. Сколько получится фенола, если в реакционную каме¬ | ||
ру подали смесь, состоящую из хлорбензола массой 11,45 г и | ру подали смесь, состоящую из хлорбензола массой 11,45 г и | ||
гидроксида натрия массой 8,0 г? | гидроксида натрия массой 8,0 г? | ||
| + | |||
| + | |} | ||
| + | |||
Учащиеся выполняют задание. Если ученики не справляют¬ся с ним, то после консультации с учителем они должны вы¬полнить его повторно в другое время. Результаты зачета отме¬чаются в таблице. | Учащиеся выполняют задание. Если ученики не справляют¬ся с ним, то после консультации с учителем они должны вы¬полнить его повторно в другое время. Результаты зачета отме¬чаются в таблице. | ||
| − | Фамилия, | + | {| border=1 |
| + | |Фамилия,Имя | ||
| + | |Устный ответ | ||
| + | |Письменная работа | ||
| + | |Совокупная оценка дифференцированного зачета | ||
| + | |Уровень | ||
| + | |- | ||
| + | |1 | ||
| + | |4 | ||
| + | |4 | ||
| + | |4 | ||
| + | |B | ||
| + | |- | ||
| + | |2 | ||
| + | |4 | ||
| + | |3 | ||
| + | |3 | ||
| + | |C | ||
| + | |- | ||
| + | |3 | ||
| + | |5 | ||
| + | |5 | ||
| + | |5 | ||
| + | |A | ||
| + | |- | ||
| + | |4 | ||
| + | |2 | ||
| + | |3 | ||
| + | |3 | ||
| + | |C | ||
| + | |- | ||
| + | |5 | ||
| + | |5 | ||
| + | |3 | ||
| + | |4 | ||
| + | |B | ||
| + | |} | ||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | ПРИЛОЖЕНИЕ. | ||
| + | |||
| + | Графический диктант. | ||
| + | |||
| + | 1вар-глицерин;2вар-этанол;3вар-фенол;4вар-метанол. | ||
| + | |||
| + | 1.бесцветная жидкость с характерным запахом. | ||
| + | |||
| + | 2.вязкая сиропообразная жидкость, сладкая на вкус. | ||
| + | |||
| + | 3.твёрдое бесцветное кристаллическое с резким запахом. | ||
| + | |||
| + | 4.ядовит. | ||
| + | |||
| + | 5.горючее в-во. | ||
| + | |||
| + | 6.нелетуч. | ||
| + | |||
| + | 7.очень хорошо растворяется в воде. | ||
| + | |||
| + | 8.неядовит. | ||
| + | |||
| + | 9.относится к ксентобиотикам. | ||
| + | |||
| + | 10.незначительно растворяется в воде. | ||
| + | |||
| + | 11.при попадании на кожу вызывает ожоги. | ||
| + | |||
| + | 12.между молекулами данного в-ва может возникать водородная связь. | ||
| + | |||
| + | Выбрать характерные реакции для вашего в-ва: | ||
| + | |||
| + | 13.реагирует с натрием. | ||
| + | |||
| + | 14.реагирует с гидроксидом нария. | ||
| + | |||
| + | 15.вступает в реакцию этерефикации. | ||
| + | |||
| + | 16. вступает в реакцию поликонденсации. | ||
| + | |||
| + | 17.взаимодействует с хлоридом железа(111) с образованием фиолетового комплексного соединения. | ||
| + | |||
| + | 18.образует ярко-синее комплексное соединение со свежеприготовленным осадком гидроксида меди(11). | ||
| + | |||
| + | 19.бромирование. | ||
| + | |||
| + | 20.дегидратация. | ||
| + | |||
| + | 21.нитрование. | ||
| + | |||
| + | 22.гидрирование. | ||
| + | |||
| + | 23. дегидрирование. | ||
| + | |||
| + | 24.дезинфицирующее ср-во. | ||
| + | |||
| + | 25.антисептик. | ||
| + | |||
| + | 26.входит в состав жиров и масел. | ||
| + | |||
| + | 27.используют для производства лаков и красок. | ||
| + | |||
| + | 28.применяют как растворитель. | ||
| + | |||
| + | 29.используется в косметике, фармацевтической и пищевой промышленности. | ||
| + | |||
| + | 30.используют для производства синтет.каучука. | ||
| + | |||
| + | 31.используют для производства лекарственных препаратов. | ||
| + | |||
| + | ОТВЕТЫ. 1вар 2,6,7,8,12,13,15,18,20,21,26,29. | ||
| + | |||
| + | 2вар1,5,7,9,12,13,15,20,23,24,27,28,30,31. | ||
| + | |||
| + | 3вар-3,4,10,11,13,14,16,17,19,21,22,25,27,31. | ||
| + | |||
| + | 4вар-1,4,5,7,12,13,15,20,23. | ||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | [[Категория: | + | [[Категория:Физика, химия, астрономия]] |
Текущая версия на 09:27, 13 июля 2009
10-й класс
Цели урока:
Обобщить пройденный материал по теме"Спирты и фенолы", систематизировать изученный материал, устранить пробелы в знаниях.
Закрепить знания учащихся о составе,строении и свойствах предельных(одноатомных и многоатомных)спиртов и фенолов.
Расширить понятия о функциональной группе ОН,водородной связи и хим.св-вах орг.соединений данных классов.
Совершенствовать умения уч-ся анализировать,сравнивать,устанавливать взаимосвязи между строением и св-вами.О
братить внимание на многообразие орг.в-в,на постепенное усложнение в-в при переходе от углеводородов к спирту и от углеводорода к фенолу.
Уделить внимание проблеме физиологического действия спиртов и вредного воздействия этанола на организм человека.На основе данного материала школьники имеют возможность сделать вывод о взаимосвязи общего и частного,о влиянии количественных изменений на изменения качественные(появление новых свойств).
Проконтролировать качество знаний, умений и навыков.
Ход урока
I. Фронтальный опрос
1.Какие соединения относятся к гидроксильным производным углеводородов?
2.Что такое спирты?
3. Что такое фенолы?
II. Повторение пройденного, обсуждение основных вопросов темы
1.Каково пространственное и электронное стро¬ение молекул предельного спирта?
ОТВЕТ.В молекулах спиртов предельный углево¬дородный радикал соединен с гидроксильной группой ОН. Атом кислорода в молекуле является самым элект¬роотрицательным, поэтому к нему смещается электрон¬ная плотность от углеводородного радикала и атома во¬дорода и возникает поляризация связи О—Н.
На доске.
2.Что вы можете отметить необычного в физи¬ческих свойствах спиртов?
ОТВЕТ. Первые представители гомологического ряда спиртов имеют аномально высокие температуры кипе¬ния и очень хорошо растворяются в воде
3. За счет чего спирты имеют высокие темпера¬туры кипения?
ОТВЕТ. За счет образования между молекулами спирта водородных связей. Молекулы спирта представ¬ляют собой комплекс, одну гигантскую молекулу.
4. Почему спирты, особенно низшие, хорошо растворимы в воде?
ОТВЕТ. За счет образования водородных связей меж¬ду молекулами спирта и воды.
5. Зависят ли свойства органических веществ от их строения?
ОТВЕТ. Да, свойства вещества зависят от его стро¬ения, и достаточно сильно. Зная свойства вещества, мож¬но предположить его строение. Например, по взаимо¬действию этанола с натрием определили, что один из атомов водорода в молекуле спирта отличается от пяти остальных большей подвижностью и, следовательно, вхо¬дит в состав полярной гидроксильной группы, а не угле¬водородного радикала. Но и по строению можно пред¬положить те или иные свойства вещества.
6. Как свойства гидроксильных производных зависят от строения их молекул?
ОТВЕТ. Попробуем с помощью цветного мела по¬казать распределение электронной плотности в молеку¬лах: а) этанола, б) глицерина, в) фенола - и предполо¬жить наличие определенных химических свойств.
На доске.
Атом кислорода оттягивает на себя элект¬ронную плотность и приобретает избыточный отрицатель¬ный заряд. Но из-за того, что углеводородный радикал отталкивает от себя электронную плотность, заряд 6- на атоме кислорода небольшой. Значит, таким же будет и положительный заряд 6+ на атоме водорода. В связи с этим подвижность атома водорода гидроксильной группы небольшая и кислотных свойств этанол (предельный од¬ноатомный спирт) проявлять не будет.
На доске.
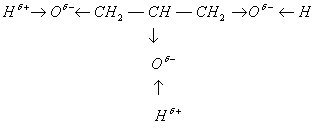
В молекуле многоатомного спирта глицери¬на углеводородный радикал распределяет электронную плот¬ность между тремя атомами кислорода. Для того чтобы со¬хранить отрицательный заряд б—, атомам кислорода при¬ходится оттягивать электронную плотность от атомов во¬дорода. Положительный заряд на этих атомах увеличивает¬ся, а значит, увеличивается их подвижность и способность к замещению. Многоатомные спирты в большей степени проявляют кислотные свойства, чем одноатомные.
На доске.
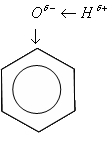
Фенол имеет бензольное кольцо, оттягива¬ющее на себя электронную плотность от атома кислоро¬да. Для сохранения отрицательного заряда атому кисло¬рода приходится оттягивать электронную плотность от атома водорода в еще большей степени, чем в предель¬ных многоатомных спиртах. Атом водорода гидроксиль¬ной группы имеет большой заряд 5+ и очень подвижен. Фенол проявляет кислотные свойства, другое его назва¬ние - карболовая кислота.
Учитель подводит итоги этой части урока и сообщает уча¬щимся, что они могут приступить к выполнению письменной работы по индивидуальным карточкам.
III. Письменная работа по индивидуальным картам Учащимся предлагаются карты различного уровня. Если вы справляетесь с заданием, например, уровня В, то при желании можете выполнить задание уровня А пол¬ностью или частично.
| Карточка 1
Уровень А 1. С помощью выданных химических реактивом распо¬знайте, в какой из пробирок содержится глицерин и фе¬нол. Ответ подтвердите уравнениями реакций (по глице¬рину). 2. Предложите методику производства 2,4.6- три нитрофе¬нола, ИСПОЛЬЗУЯ в качестве ИСХОДНЫХ веществ метан, аммиак и другие вещества. Объясните, почему замещение атомов во¬дорода в феноле при нитровании происходит в положениях 2, 4, 6. Назовите вещества. 3. Приведите сравнительный анализ строения и свойств фенола и толуола. Выявите общие черты и отличия в их свой¬ствах. Объясните причины сходства и различия в свойствах этих соединений. Напишите уравнения соответствующих уравнений реакций. 4. Напишите уравнения реакций, которые могли бы про¬демонстрировать генетическую связь между углеводородами и фенолами. 5. Сколько получится метана при сплавлении ацетата на¬трия массой 10 г и натронной извести массой 10 г, массовая доля гидроксида натрия в которой 80%? |
| Карточка 2
Уровень В 1. С помощью предложенных химических реактивов рас¬познайте, в какой из двух выданных пробирок находятся ра¬створы глицерина и фенола. Ответ подтвердите уравнения¬ми реакций (по глицерину). 2. Проведите сравнительный анализ электронного стро¬ения молекул фенола и бензола. Для этою используйте следующий перечень признаков сравнения: распределение электронной плотности п-электронного облака бензольного ядра, распределение электронной плотности связи О-Н в феноле; наличие атомов водорода в молекуле, замещаю¬щихся в реакциях бромирования и нитрования. Объясни¬те причины выявленных различий. 3. Проведите сравнительный анализ основных химиче¬ских свойств фенола и толуола. Для этого используйте сле¬дующий перечень признаков сравнения: кислотные свой¬ства; отношение к бромной воде, азотной кислоте, натрию и гидроксиду натрия. Объясните причины выявленных раз¬личий. 4. Напишите уравнения реакций, лежащих в основе по¬лучения фенола. Где, на ваш взгляд, должны располагаться предприятия по его производству? Где фенол и его произ¬водные применяют? Напишите уравнения реакций, с помо¬щью которых можно осуществить превращения: а) метан -> ацетилен -> бензол -> фенол -» 2,4,6-три- бромфенол; б) пропан -» гексан -> циклогексан ~> бензол -> фенол -» фенолят натрия. 5. Сколько получится метана, если в реакционную каме¬ ру для прямого синтеза метана направить смесь, состоящую из углерода массой 2,4 г и водорода объемом 11,2 л? |
| Карточка 3
Уровень С 1. С помощью предложенных химических реактивов рас¬познайте, в какой из выданных пробирок находятся ра¬створы глицерина и фенола. При необходимости исполь¬зуйте таблицу качественных реакций на органические ве¬щества. 2. Опишите физические и химические свойства фенола. Обратите внимание на те из них, которые объединяют фе¬нол со слабыми кислотами. Напишите уравнения реакции, при помощи которой можно доказать, что фенол — слабая кислота. 3. Напишите уравнения реакций, при помощи которых можно было бы продемонстрировать генетическую связь между алканами, циклоалканами, ароматическими углево¬ дородами и фенолами. Используйте для этого схемы превращении: а) метан -► ацетилен -> бензол -» хлорбензол -> фенол; б) гексан -> циклогексан -> бензол -> фенол —> фенолят натрия. 4. Сколько получится фенола, если в реакционную каме¬ ру подали смесь, состоящую из хлорбензола массой 11,45 г и гидроксида натрия массой 8,0 г? |
Учащиеся выполняют задание. Если ученики не справляют¬ся с ним, то после консультации с учителем они должны вы¬полнить его повторно в другое время. Результаты зачета отме¬чаются в таблице.
| Фамилия,Имя | Устный ответ | Письменная работа | Совокупная оценка дифференцированного зачета | Уровень |
| 1 | 4 | 4 | 4 | B |
| 2 | 4 | 3 | 3 | C |
| 3 | 5 | 5 | 5 | A |
| 4 | 2 | 3 | 3 | C |
| 5 | 5 | 3 | 4 | B |
ПРИЛОЖЕНИЕ.
Графический диктант.
1вар-глицерин;2вар-этанол;3вар-фенол;4вар-метанол.
1.бесцветная жидкость с характерным запахом.
2.вязкая сиропообразная жидкость, сладкая на вкус.
3.твёрдое бесцветное кристаллическое с резким запахом.
4.ядовит.
5.горючее в-во.
6.нелетуч.
7.очень хорошо растворяется в воде.
8.неядовит.
9.относится к ксентобиотикам.
10.незначительно растворяется в воде.
11.при попадании на кожу вызывает ожоги.
12.между молекулами данного в-ва может возникать водородная связь.
Выбрать характерные реакции для вашего в-ва:
13.реагирует с натрием.
14.реагирует с гидроксидом нария.
15.вступает в реакцию этерефикации.
16. вступает в реакцию поликонденсации.
17.взаимодействует с хлоридом железа(111) с образованием фиолетового комплексного соединения.
18.образует ярко-синее комплексное соединение со свежеприготовленным осадком гидроксида меди(11).
19.бромирование.
20.дегидратация.
21.нитрование.
22.гидрирование.
23. дегидрирование.
24.дезинфицирующее ср-во.
25.антисептик.
26.входит в состав жиров и масел.
27.используют для производства лаков и красок.
28.применяют как растворитель.
29.используется в косметике, фармацевтической и пищевой промышленности.
30.используют для производства синтет.каучука.
31.используют для производства лекарственных препаратов.
ОТВЕТЫ. 1вар 2,6,7,8,12,13,15,18,20,21,26,29.
2вар1,5,7,9,12,13,15,20,23,24,27,28,30,31.
3вар-3,4,10,11,13,14,16,17,19,21,22,25,27,31.
4вар-1,4,5,7,12,13,15,20,23.