Путешествие в мир кислот
| Строка 220: | Строка 220: | ||
| − | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | |||
| + | '''Вариант ответа:''' | ||
| + | [[Изображение:Axmerova 131.png|left|600px]] | ||
| Строка 243: | Строка 258: | ||
'''Выполнение Задания № 2.''' | '''Выполнение Задания № 2.''' | ||
| − | 1-уровень: перепишите формулы кислот в тетрадь: HCI, H2SO4, H3PO4. Назовите кислоты. В формулах подчеркните кислотные остатки, определив их заряд иона. | + | * '''1-уровень:''' перепишите формулы кислот в тетрадь: HCI, H2SO4, H3PO4. Назовите кислоты. В формулах подчеркните кислотные остатки, определив их заряд иона. |
| − | 2-уровень: перепишите формулы кислот в тетрадь: HNO3, H2S, HBr, H2CO3. Назовите кислоты. В формулах подчеркните кислотные остатки, определив их заряд иона. | + | * '''2-уровень:''' перепишите формулы кислот в тетрадь: HNO3, H2S, HBr, H2CO3. Назовите кислоты. В формулах подчеркните кислотные остатки, определив их заряд иона. |
| − | 3-уровень: перепишите формулы кислот в тетрадь: HNO2, H2SO3, HI, H2SiO3, HF. Назовите кислоты. В формулах подчеркните кислотные остатки, определив их заряд иона. | + | * '''3-уровень:''' перепишите формулы кислот в тетрадь: HNO2, H2SO3, HI, H2SiO3, HF. Назовите кислоты. В формулах подчеркните кислотные остатки, определив их заряд иона. |
| − | (Учитель организует взаимопроверку). | + | |
| + | '''(Учитель организует взаимопроверку).''' | ||
Версия 16:02, 26 октября 2013
ПЛАН-КОНСПЕКТ УРОКА ХИМИИ "ПУТЕШЕСТВИЕ В МИР КИСЛОТ"
Ахмерова Елена Юрьевна, учитель химии и биологии,
МБУ гимназии № 77 г.о.Тольятти
Цель урока:
Образовательные: продолжить формирование понятий об основных классах неорганических соединений – классе кислот; организовать деятельность учащихся по изучению состава, номенклатуры и классификации кислот; продолжить работу по выработке навыков и умений работать с лабораторным оборудованием и химическими веществами, сформировать умения экспериментировать, наблюдать, анализировать опыты, делать выводы.
Развивающиеся: создать условия для повышения познавательной активности учащихся в приобретении новых знаний; развивать самостоятельность и креативность мышления; развивать умения учащихся работать в парах, совершенствуя практические умения и навыки.
Воспитательные: содействовать формированию у учащихся естественно-научной картины мира; обогатить представление учащихся об общем, особенном и единичном в составе и свойствах кислот; воспитывать уверенность в своих силах, умение действовать самостоятельно.
Оборудование к уроку:
Печатные источники:
- Габриелян О.С. Химия. 8 класс
- Габриелян О.С. Рабочая тетрадь к учебнику Габриеляна О.С.
- Габриелян О.С. Тетрадь для лабораторных опытов и практических работ
- Габриелян О.С. Настольная книга учителя
- Таблицы “Кислоты”, “Периодическая система химических элементов Д.И. Менделеева”, “Таблица растворимости”
Оборудование: химические стаканчики, химические вещества.
Презентация к уроку.
Реактивы:
- Набор неорганических кислот: серная, соляная, азотная, фосфорная
- Набор органических кислот: аскорбиновая, уксусная
- Яблоко, лимон, кефир.
- Набор индикаторов: фенолфталеин, лакмус, метиловый оранжевый.
Тип урока: Изучение нового материала, первичное закрепление.
Технологии, используемые на уроке:
- технология проблемно-диалогического изучения данного материала;
- технология разноуровневого обучения (выполнение заданий);
- технология проектного обучения (начало исследовательской деятельности);
- ИКТ - технология ( презентация).
Девиз: “Просто знать – еще не все знания,
нужно уметь использовать”. (Иоганн Гете)
Ход урока:
1. Организационный момент. Взаимные приветствия.
Фиксация отсутствующих; проверка внешнего состояния класса и готовность учеников к уроку; организация внимания и психологический настрой учеников на проведение урока-путешествия.
2. Изучение новой темы.
Ребята! Сегодня я вас приглашаю совершить путешествие в мир кислот. Девизом нашего необычного урока-путешествия будет: “Просто знать – еще не все, знания нужно уметь использовать”. Путешествие предлагаю начать с записей в путевом дневнике. А путевым дневником будет ваша рабочая тетрадь. По пути следования мы сделаем несколько остановок на таких станциях, как: информационная, историческая, экспериментальная, практическая.
И так в добрый путь!
На доске – презентация. Слайд 2. ( ИКТ-технология)
Мы прибываем на станцию Информационную.
Где встречаются кислоты в природе? (Учитель задает вопрос учащимся и стремится к тому, чтобы учащиеся сами пытались решать проблему через фрагмент из дополнительных источников)
Слайды 3,4,5,6.
Учитель сообщает о том, что лимонная кислота встречается в лимонах, яблочная – в яблоках, щавелевая – в листья щавеля и др. Но! Есть такие кислоты, которые не встречаются в природе и получены они искусственным путем. К ним относятся: серная, соляная, азотная, фосфорная, угольная кислоты и др. (Учитель пишет несколько химических формул кислот на доске)
Ребята, а что общего вы нашли в строении данных кислот? (Учитель дополняет: а все оставшееся это остатки, а если остатки эти у кислот, то остатки будет называться кислотными и так, даем определение).
Кислотами называют сложные вещества, молекулы которых состоят из атомов водорода и кислотного остатка. Общая формула кислот: НхКО, где Нх – атом водорода, а КО – кислотный остаток.
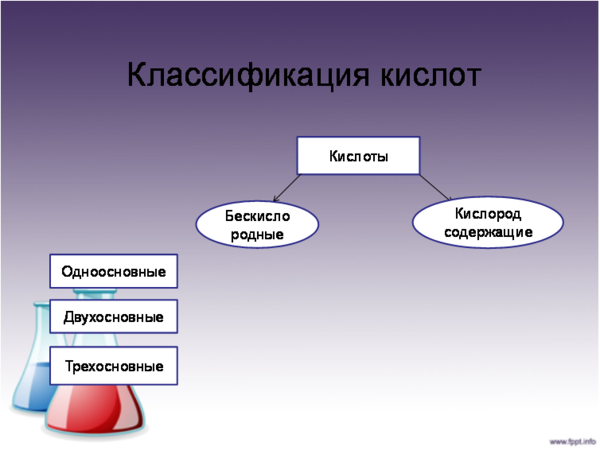
Состав кислотных остатков различен: в одни входит кислород, в другие нет. Классифицируем кислоты по двум признакам:
- По числу атомов водорода: а). одноосновные, б). двухосновные, в). трехосновные;
- По наличию кислорода в кислотном остатке : а). бескислородные, б). кислородсодержащие.
Выполнение Задания № 1.
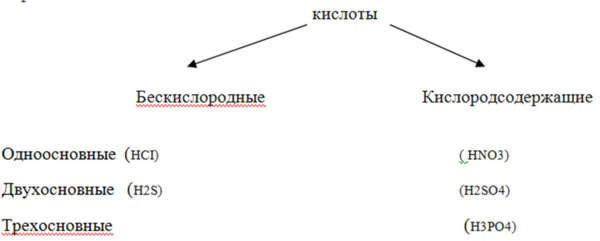
Пассажирам разложить карточки с формулами кислот перед собой и составить схему в тетради:
Вариант ответа:
Выполнение Задания № 2.
- 1-уровень: перепишите формулы кислот в тетрадь: HCI, H2SO4, H3PO4. Назовите кислоты. В формулах подчеркните кислотные остатки, определив их заряд иона.
- 2-уровень: перепишите формулы кислот в тетрадь: HNO3, H2S, HBr, H2CO3. Назовите кислоты. В формулах подчеркните кислотные остатки, определив их заряд иона.
- 3-уровень: перепишите формулы кислот в тетрадь: HNO2, H2SO3, HI, H2SiO3, HF. Назовите кислоты. В формулах подчеркните кислотные остатки, определив их заряд иона.
(Учитель организует взаимопроверку).
Мы прибываем на станцию Историческую.
Слайды 10,11,12.
Уксусная кислота. « Древесная кислота»- около 3 тысяч лет. Серная кислота (10 век). Соляная и азотная кислоты были выделены и определены химиками примерно в 15 веке. Угольная кислота- 18 век. Учащиеся отмечают, что общее в составе кислот и строении обуславливает и общие свойства кислот. Придумайте к слову “кислота” прилагательное. Слова “кислота” и “кислый” имеют один корень, и действительно, кислоты имеют кислый вкус (яблочная, лимонная кислоты). К тому же, многие из вас пробовали лимонную кислоту на вкус. Помните о том, что эта кислота пищевая! Однако, не все кислоты можно пробовать на вкус, так как многие из них ядовиты. Если пробуешь на вкус Ты все непременно, Может, мальчик, ты не трус, Но глупец отменный!
Мы прибываем на станцию Экспериментальную. Внимание! Внимание! Внимание! На пути нашего следования зажигается красный свет, который требует остановиться. Серную, соляную, азотную, фосфорную кислоты получают искусственным путем. Такие кислоты называют концентрированными, но очень часто приходится работать с разбавленными кислотами. Нужно всегда помнить, кислоту надо приливать в воду, а не наоборот. (Учитель дает пояснения)
Как можно распознать кислоты, не пробуя на вкус?
Правильно, с помощью индикаторов (лакмуса, фенолфталеина, метилового оранжевого)
Работа с учебником с.106
Сообщение об индикаторах. Слайд 14
Повторение ТБ при работе с кислотами. Выполнение лабораторного опыта по инструктивным карточкам и оформление отчета.
Выполнение задания № 3.
Учащиеся под руководством учителя готовят растворы кислот, соблюдая правила техники безопасности, наблюдают выделение теплоты при растворении кислот в воде. Затем к кислотам приливают индикаторы. Заполняют таблицу:
Действие кислот на индикаторы (слайд15).
Формула и название кислот
индикаторы
фенолфталеин лакмус метиловый оранжевый Соляная кислота Серная кислота Азотная кислота Уксусная кислота
Выводы: раствор индикаторов в кислой среде меняет окраску Затем учитель предлагает учащимся с помощью эксперимента выяснить, отличаются ли соляная и серная кислоты от кислот, входящих в продукты питания.
Учащиеся действуют на сок лимона, кефир индикатором и отмечают изменение окраски раствора лакмуса, что дает возможность сделать вывод: все кислоты проявляют общие свойства, обусловленные общностью их строения. Учитель подводит итоги.
Мы прибываем на станцию Практическую. 3. Закрепление
Выполнение задания № 4.
Мы прибываем на станцию практическую. Мы с вами устали и теперь давайте поиграем в игру “третий лишний” А) HCI, HNO3, H3PO4 Б) H2SiO3, HF, HI В) H2SO4 H2S H3BO3
Учащиеся выполняют задания в тетради.
Наше путешествие в страну кислот закончилось.
Мы вспомнили такие ранее изученные понятия, как оксиды, основания.
Узнали новые понятия такие, как кислоты, кислотный остаток и другие.
Мы отработали такие умения, как правильное обращение с кислотами.
И к концу урока мы четко уяснили, что кислоты – это еще один класс неорганических соединений. Нам необходимы не только теоретические знания о них, но и практические умения работать с ними, соблюдая правила техники безопасности. Хотя на данном этапе наш урок-путешествие закончен, но мы с вами будем и в дальнейшем знакомиться и изучать свойства таких веществ, как кислоты. Нам предстоит узнать еще очень много нового и интересного не только о кислотах, но и о других веществах.
4. Рефлексия.
А теперь, мне хотелось бы узнать ваше мнение о данном уроке. Для этого выполните рефлексивный тест:
1 .Я узнал много нового материала 2.Мне это пригодится в жизни 3. На все возникшие вопросы я получила ответы 4. На уроке я поработала добросовестно.
5.Домашнее задание.
Прочитать с.102 – 107 , ответить на вопрос № 3 (письменно) и проделать эксперимент Домашний эксперимент. Слайд 20, 21.
Вам необходимо в домашних условиях исследовать действие раствора лимонной кислоты (его можно заменить соком квашеной капусты) на лист любого комнатного растения. Написать мини-отчет и сделать вывод.
На этом наш урок закончен. Спасибо за работу!